Микробиом: зоопарк в вашем животе
15 декабря 2022 г.
В вашем организме живет столько же бактерий, сколько и ваших собственных клеток тела. Бактериями наш портативный микробиологический музей не ограничен: в организме постоянно проживает огромное разнообразие вирусов, архей, грибков и простейших. А пищеварительная система — особенно благоприятное место для бактерий — буквально ими набита.
Абсолютно необходимая часть организма здорового человека
Бактериями наш портативный микробиологический музей не ограничен: в организме постоянно проживает огромное разнообразие вирусов, архей, грибков и простейших. Но не торопитесь проводить дезинфекцию: микробиом — абсолютно необходимая часть организма здорового человека, без которой мы бы не смогли питаться многими продуктами, страдали бы из-за проблем с иммунитетом, а также от множества инфекций, которые обычно обходят нас стороной.
Давайте же узнаем побольше о наших микроскопических соседях, которые почти бескорыстно делают жизнь каждого человека приятнее.
Кишечник — слишком замечательное место, чтобы оставаться незаселенным. В нём тепло, в него регулярно поступает пища, он защищен от непогоды, хищников и множества других ударов судьбы. Ничего удивительного, что в кишечнике любого животного обитает множество микроорганизмов, составляющих его микрофлору (микробиом, микробиоту).
Со своей стороны животное может только позаботиться о том, чтобы микробы не размножались слишком сильно и чтобы среди микроскопических пассажиров было как можно больше полезных или хотя бы безвредных существ. Над этим нужно начинать работать прямо с рождения.
Становление микрофлоры кишечника
Новорождённые млекопитающие плохо умеют заботиться о себе и потому не могут предпринять разумных шагов по созданию в своем кишечнике благоприятной микрофлоры. Эту роль берёт на себя мать: в ее молоке содержатся не только микроорганизмы, но и антитела, иммунные клетки и цитокины, которые помогают правильно организовать взаимодействие иммунной системы младенца с его новыми спутниками жизни. Кроме того, в молоке содержатся вещества, стимулирующие рост полезных бактерий: в частности, определенные олигосахариды способствуют размножению бифидобактерий.
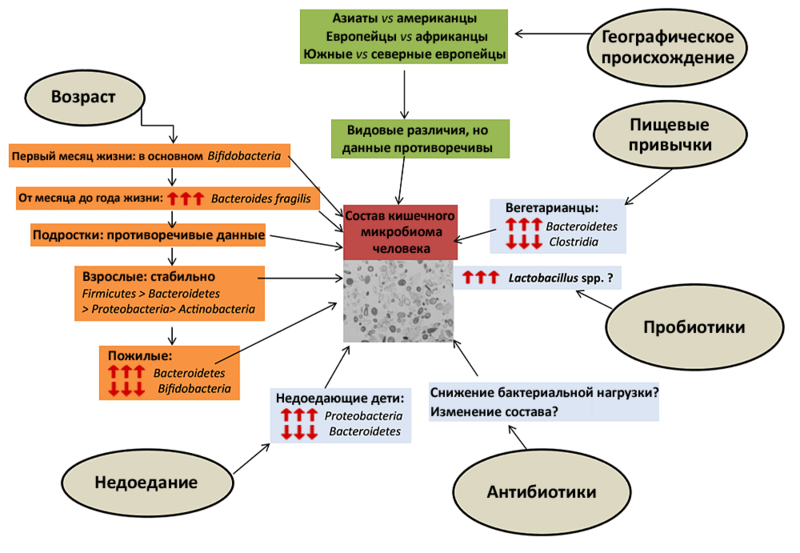
То, что первых микробов младенец получает от матери, сказывается на его дальнейшей жизни: микрофлора матери и ее ребенка более сходна, чем у двух случайно взятых людей. При этом бактериальные сообщества кишечника двуяйцевых близнецов сходны в той же мере, что и у однояйцевых. Поскольку генетическая информация у однояйцевых близнецов идентична, а у двуяйцевых сходна не более, чем у родившихся в разное время братьев, получается, что генетический компонент оказывает на формирование бактериальной микробиоты лишь незначительное влияние. Основной вклад в ее развитие вносят внешние условия (рис. 1).
Рисунок 1. Основные внешние факторы, влияющие на состав микрофлоры. Генетика вносит в состав микрофлоры лишь минимальный вклад, зато обстоятельства жизни человека могут на нее повлиять очень существенно. Причем некоторым факторам — например, антибиотикам или резкой смене диеты — для этого достаточно лишь нескольких дней (правда, краткосрочные воздействия вызывают быстро обратимые изменения). Красные стрелки, направленные вверх, обозначают увеличение доли той или иной группы бактерий в кишечном микробиоме, и наоборот.
Полноценная микрофлора, разнообразие видов которой так же велико, как и у взрослых, формируется у ребенка к трем годам. До этого возраста иммунная система относится к микробам терпимее, поскольку ребенок еще только заполняет свой микрозоопарк. Это — одна из причин, по которым маленькие дети особенно чувствительны к инфекциям. Зато когда микрофлора наконец сформируется, ее преимущества окупят жертвы и опасности первых лет жизни.
Иммунитет и микробиом
Иммунная система должна обращаться с микробиотой очень аккуратно: с одной стороны, она должна позволять микробам спокойно жить в отведенном месте (кишечнике), но с другой стороны, должна оперативно реагировать, когда они нарушают установленные границы или начинают слишком активно размножаться.
Казалось бы, от этой дополнительной нагрузки на иммунную систему, которая и так должна чутко реагировать на все угрозы здоровью, поддерживать гомеостаз должно быть сложнее. Удивительно, но это не так.
Эксперименты показывают, что в отсутствие микробиоты иммунная система развивается и функционирует намного хуже. Это привело ученых к мысли, что хозяин использует микроскопических сожителей как своеобразный тренажер, который позволяет держать иммунитет в тонусе.
Чтобы проверить это, а также многие другие предположения о роли микробиоты, ученые исследуют гнотобиотических мышей — животных, которых выращивают в тщательно контролируемых условиях, так что исследователям точно известен состав их микрофлоры. У гнотобиотических мышей может или совсем не быть микробиоты, или она может состоять из строго определенного набора видов, подселенных в их организмы учеными. Выяснилось, что у мышей без микробиоты образуется меньше CD4+ T-клеток и плазматических клеток, нарабатывающих антитела IgA [6]. А в кишечнике таких животных нарушается структура лимфоидных фолликулов — важных органов иммунной системы, в которых B-лимфоциты приобретают рецепторы, помогающие им распознавать вредоносные молекулы.
Кроме этого, микробиота необходима, чтобы научить иммунитет здоровой толерантности, благодаря чему он не пытается атаковать, к примеру, поступающую пищу.
Было показано, что активное подавление воспалительных процессов, которые могут развиваться в ответ на антигены пищи, невозможно без микробиома. Бактерии кишечника играют роль и в запуске антивирусных ответов. Большинство T-клеток, нарабатывающих интерферон-гамма (вещество, подавляющее распространение вирусов), обнаруживается в пищеварительном тракте. И именно специфические местные бактерии стимулируют синтез интерферона-гамма этими клетками.
Помимо сложных молекулярных взаимодействий, благодаря которым микробиом стимулирует иммунную систему работать эффективнее, в арсенале микробиоты есть и более простой способ помощи иммунной системе. Постоянные представители микрофлоры конкурируют с другими микробами за определенные метаболиты и просто не оставляют ресурсов для жизни посторонних, потенциально опасных микробов. Кроме того, регуляция микробиотой состава среды влияет на активности генов вирулентности патогенных микроорганизмов (например, Salmonella enterica и Clostridium difficile).
Микрофлора и питание
Микроорганизмы способны питаться такими субстратами, которые, к счастью, большинству людей и не снились. Это означает, что разнообразие пищеварительных ферментов у микробов намного выше, чем у людей. Грех этим не воспользоваться, раз уж бактерии и другие микроорганизмы неизбежно заселяют кишечник.
В пищеварительном тракте человека живут микробы, способные расщеплять целлюлозу (клетчатку) — основной сложный углевод растений. У нас в кишечнике переваривается далеко не вся целлюлоза из растительной пищи, но без микробиоты растениями было бы вообще энергетически невыгодно питаться.
Бактерии не только помогают нам расщеплять субстраты, которые мы сами не в состоянии переварить, но и синтезируют полезные соединения, которые всасываются в кишечнике вместе с пищей. Например, бактерии синтезируют витамин K, витамины группы B, а также тетрагидрофолат — кофермент, необходимый для метаболизма аминокислот.
Кроме того, бактерии помогают нам усваивать минеральные вещества — в первую очередь, железо. Мыши с нормальной микробиотой могут долгое время жить на диете с низким содержанием железа, потому что бактерии выделяют специальные белки, позволяющие с высокой эффективностью улавливать эти ионы. А вот у мышей без микробиоты при низком содержании железа в пище развивается анемия.
Интересно, что состав кишечной микрофлоры меняется в зависимости от диеты. Так, было показано, что у жителей западных стран, рацион которых богат белками и животными жирами, в микробиоте больше бактерий рода Bacteroides, а у жителей более бедных регионов (африканские деревни, Венесуэла), в которых люди питаются в основном растительными продуктами, богатыми сложными углеводами, преобладают виды рода Prevotella. Похожие изменения микробиоты, связанные с разными стилями жизни, характерны для горожан и деревенских жителей.
Сколько времени нужно, чтобы рацион повлиял на состав микрофлоры? Эксперимент американских ученых показал, что в экстремальных случаях — для диет, состоящих только из продуктов растительного или животного происхождения — достаточно и четырех дней.
География микробиома
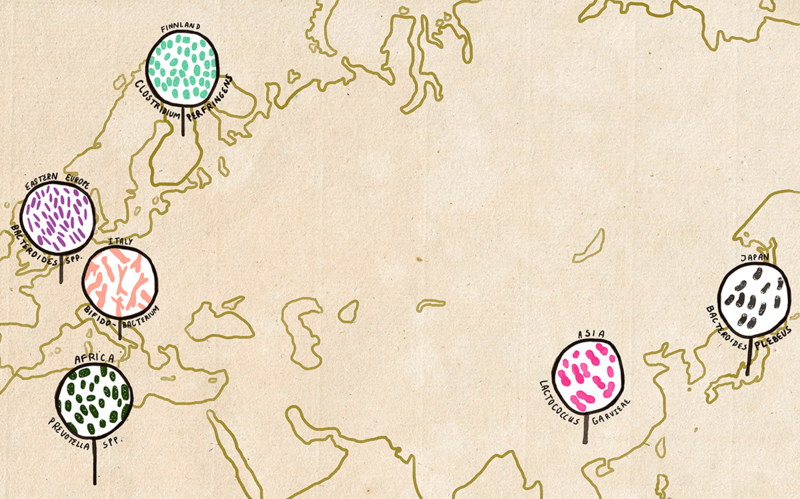
Как оказалось, в микробиоте человека можно отследить и особенности, связанные с регионом его проживания. Например, бактерия Bacteroides plebeius, помогающая переваривать гликаны морских водорослей (нори и других) обнаруживается пока только у жителей Японии. Интересно, что ген гликозидной гидролазы, которая позволяет Bacteroides plebeius переваривать морские водоросли, был обнаружен у бактерий, постоянно живущих на таких водорослях. Очень вероятно, что именно от них этот ген попал в микробиоту японцев — путем горизонтального перенос.
У жителей Азии распространен и другой полезный микроб — Lactococcus garvieae. Эта бактерия при переваривании сои выделяет S-эквол — соединение, предотвращающее развитие климактерических симптомов и некоторых типов опухолей благодаря взаимодействию с рецепторами эстрогенов. Этим и объясняется положительный эффект употребления сои в борьбе с онкологическими заболеваниями.
Вот только бактерии, благодаря которым он проявляется, встречаются у европеоидов далеко не так часто, как у азиатов: в странах Запада — приблизительно у одного человека из четырех, а в Китае, Корее и Японии — у каждого второго.
Некоторым национальным особенностям микробиома еще не найдены объяснения. Например, пока непонятно, почему у итальянцев в два-три раза больше бифидобактерий, чем у жителей других европейских государств.
Тем не менее такие характерные особенности микробиома интересно изучать: даже если их причины не ясны, они могут многое рассказать об истории человечества.
Региональные различия начинают проявляться с самого раннего возраста. Так, было показано, что у шестимесячных финнов и жителей африканской республики Малави доли бифидобактерий, представителей Bacteroides-Prevotella, а также патогена Clostridium histolyticum различаются в разы.
Получается, что регион, в котором родился ребенок, имеет большое значение для его будущего микробиома.
Микробиом и болезни
Микробные сообщества, населяющие наш организм, богаты видами и сложно устроены.
Особенно это характерно для кишечника, в котором и число видов бактерий, и плотность микробов на единицу пространства впечатляюще велики. В кишечнике каждого человека образуется отдельная экосистема со сложными петлями обратной связи, которые контролируют численность различных микробов. Нарушения благоприятного видового баланса могут приводить к самым разным проблемам со здоровьем.
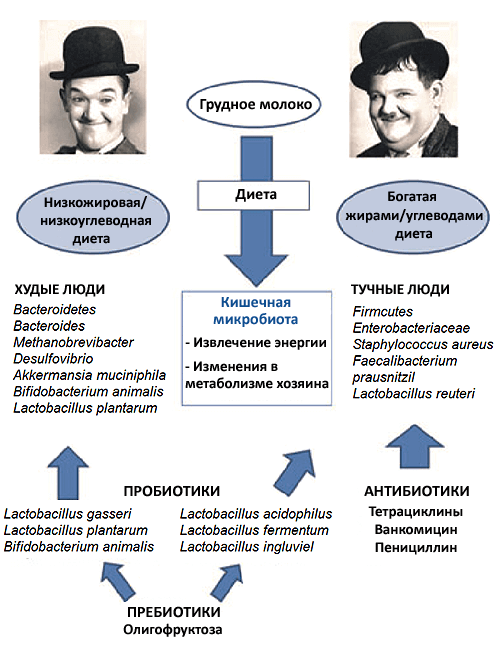
Например, было установлено, что при ожирении снижается разнообразие видов микрофлоры кишечника (рис. 2). Причем эксперименты показывают, что изменения микрофлоры относятся к причинам ожирения, а не к его следствиям.
Если кишечник мышей без микробиоты заселить бактериями мышей с ожирением, животные будут набирать вес быстрее, чем в случае пересадки кишечной микробиоты худых мышей.
Зная лишь состав микробиоты, можно определить, есть ли у человека ожирение, с вероятностью 90%.
Рисунок 2. Влияние микробиоты кишечника на развитие ожирения. Целый ряд работ показал, что изменение микрофлоры кишечника у людей и животных с ожирением — это не следствие, а одна из причин появления лишнего веса. По сравнению с микрофлорой людей с нормальным весом, микрофлора людей с ожирением беднее, и соотношение бактерий разных групп в ней иное. Обладатели такой микрофлоры быстрее набирают вес, чем «обычные» люди, даже при абсолютно одинаковых рационах.
Разнообразие микробиоты кишечника снижается и при рецидивирующем псевдомембранозном энтероколите, и при хронических воспалительных заболеваниях кишечника. При болезни Крона, относящейся к последним, в подвздошной кишке исчезают обычно многочисленные представители Faecalibacterium и Roseburia, а их место занимают Enterobacteriaceae и Ruminococcus gnavus.
С изменением бактериального состава кишечной микрофлоры удается связать заболевания, не имеющие прямого отношения к пищеварению. Так, для пациентов с симптомами атеросклероза характерно увеличение доли кишечных бактерий Collinsella за счет уменьшения доли Roseburia и Eubacterium, а наличие бактерий Helicobacer pylori снижает вероятность развития астмы и аллергии.
Интересно, что патогенные штаммы той же Helicobacer pylori провоцируют развитие гастрита (как минимум). Именно поэтому недостаточно знать видовой состав микробов кишечника, чтобы делать выводы о здоровье человека, а нужно учитывать еще и их штаммы — внутривидовые группы, которые могут очень сильно отличаться по патогенности и другим свойствам.
Исследования на мышах показали, что и присутствие патогенных бактерий в пищеварительном тракте, и развитие воспалительных заболеваний кишечника повышают у животных тревожность.
Антибиотики и микрофлора
Антибиотики (антибактериальные препараты) действуют не только на патогенных микробов, но и на полезных представителей микробиома, существенно влияя на организм.
Принимая антибиотики, можно изменить стабильное состояние микробиоты, причем эффект может сохраняться годами. Поддерживается стабильным не только состав микробного сообщества, установившийся после употребления антибиотиков, но и экспрессия его членами генов устойчивости к антибиотикам — то есть со временем бактерии не теряют резистентность к лекарствам.
В отсутствие селективного давления гены устойчивости распространяются среди кишечных бактерий слабо, но если употреблять антибиотики, эффективность горизонтального переноса повысится, а значит, активнее будут передаваться и гены устойчивости.
Кроме того, антибиотики — один из видов стресса, запускающих SOS-репарацию, которая ведет к возникновению множества мутаций и появлению новых генов устойчивости.
Поэтому антибиотики не только способствуют росту устойчивых популяций бактерий, но и создают новые, благоприятствуя горизонтальному переносу генов и появлению новых типов устойчивости.
В долгосрочной перспективе любое употребление антибиотика приближает срок, когда он из эффективного препарата превратится в бесполезное вещество. В том числе и поэтому антибиотики лучше принимать только в случае крайней необходимости и по рецепту врача. Истощение микробиома антибиотиками не только приводит к неприятным симптомам (например, диарее), но и снижает устойчивость всего сообщества к патогенным бактериям.
Про- и пребиотики
Про- и пребиотики — это препараты, которые могут способствовать восстановлению микрофлоры после ее нарушения, например, из-за приема антибиотиков.
Пробиотики — это культуры полезных микроорганизмов, чаще всего к ним относят бифидо- и лактобактерий.
Пребиотики — это вещества (субстраты), стимулирующие рост таких бактерий: например, инулин, олигосахариды фруктозы и галактозы, пищевые волокна (в частности, полисахариды, которые человек не способен переварить без помощи бактерий).
Пребиотики выпускают в виде пищевых добавок, но они и так в больших количествах содержатся во многих продуктах, с помощью которых можно поддержать рост полезных бактерий: в злаках, цикории, бобовых, чесноке, луке, бананах.
Пробиотики также продают в виде специальных препаратов (БАДов), но их можно приобрести и в составе различных кисломолочных продуктов с бифидо- и лактобактериями.
Производители йогуртов активно финансируют исследования эффектов пробиотиков на самые разные аспекты жизни человека. В таких случаях часто можно ожидать сильного перекоса в публикации результатов: афишироваться будут в основном выгодные спонсорам результаты, а нейтральные или отрицательные данные останутся неизвестными общественности.
Действительно, есть основания думать, что опубликованные данные о положительных эффектах пробиотиков слишком хороши, даже если считать все опубликованные результаты полученными честно. В частности, работ, в которых эффект пробиотиков несколько слабее среднего по всем исследованиям, публикуется меньше, чем должно. Поэтому, читая о пробиотиках, нужно помнить, что нам, скорее всего, предлагают не всю информацию об их эффектах.
Тем не менее то, что известно, выглядит очень неплохо. Согласно некоторым исследованиям, пробиотики помогают при синдроме раздраженного кишечника, диарее, вызванной антибиотиками или химиотерапией, энтероколите и непереносимости лактозы.
Благоприятным влиянием на пищеварение положительные эффекты пробиотиков не ограничиваются. Было показано, к примеру, что препараты штаммов Lactobacillus. помогают бороться с тревожностью, если начать употреблять их на ранних стадиях долгосрочного стресса. Микрофлора влияет на уровень кортикостерона — главного гормона стресса, — поэтому пробиотики могут помочь почувствовать себя лучше не только физически, но и морально.
Пересадка микробиоты
Пробиотики рассчитаны на употребление с пищей — то есть бактерии должны успешно пройти через желудок с агрессивной кислой средой, чтобы добраться до места назначения. Это не очень эффективный способ доставки, и значительная часть бактерий в составе препаратов-пробиотиков может не пережить такого путешествия. Поэтому иногда донорскую микробиоту (в виде гомогенизированных фекалий) с помощью колоноскопии подсаживают прямо в ту часть кишечника, где она должна находиться. Это значительно эффективнее доставки бактерий с пищей, но и намного более трудоемко, так что данных о такой терапии пока мало.
Тем не менее уже известно, что этим методом успешно лечится псевдомембранозный энтероколит, причем с помощью простой фекальной клизмы еще полвека назад удавалось справиться с его молниеносными формами, смертность при которых достигала 75%.
Известны также единичные случаи использования пересадки микробиоты для лечения синдрома раздраженного кишечника, разных воспалительных заболеваний кишечника, а также метаболического синдрома.
Микробиота и рак
Особо тяжелые формы заболеваний, связанных с появлением патогенных бактерий или нарушением баланса видов микрофлоры, могут приводить к возникновению рака.
Например, атрофический гастрит и иногда образующийся при развитии этого заболевания рак связывают с размножением патогенных штаммов бактерий Helicobacter pylori. А многие случаи рака толстой кишки — с размножением Fusobacterium spp., Streptococcus gallolyticus, некоторых представителей семейства Enterobacteriaceae и энтеротоксигенных штаммов Bacteroides fragilis.
Посредством микробиоты может привести к раку даже нездоровое питание: при высоком содержании в пище жиров бактерии начинают производить больше дезоксихолевой кислоты, способствующей развитию рака печени.
Риск образования рака при нарушении нормальной микробиоты — еще одна причина, по которой важность заботы о микроскопическом населении организма человека сложно переоценить. Хорошая новость состоит в том, что риск развития рака, связанного с бактериями пищеварительного тракта, можно предсказать, исследуя микробиом.
Даже если ситуация вышла из-под контроля, микрофлора всё же может помочь организму бороться с онкологией. Описан, к примеру, такой механизм: от действия химиотерапевтического препарата циклофосфамида страдают не только опухолевые клетки, но и клетки кишечника. Микроорганизмы выходят наружу, а иммунная система активизируется, чтобы справиться с распространением микрофлоры за пределы кишечника. При этом усиленная активность иммунной системы помогает организму бороться с раком.
Микробиота и лекарства
В последнее время обнаруживается всё больше лекарств, на эффект которых влияет микробиота. Бактерии могут модифицировать молекулы лекарства, влияя на их метаболизм. А иногда такие модификации просто необходимы, чтобы лекарства работали.
Интересный пример — это некоторые средства восточной медицины, не действующие на людей, у которых нет определенных бактерий в составе микрофлоры. Например, женьшень не оказывает благоприятного противовоспалительного эффекта приблизительно на одного человека из пяти.
Состав бактерий кишечника определяет эффективность действия популярного анальгетика парацетамола (ацетаминофена). Его метаболизм зависит от уровня p-крезола — микробного метаболита, который конкурирует с парацетамолом за связывание с ферментом, присоединяющим сульфогруппу. Чем больше микробного p-крезола, тем реже сульфогруппы присоединяются к молекулам парацетамола.
Некоторые бактерии кишечника и сами производят вещества с лекарственными свойствами. Например, Clostridium sporogenes выделяет индол-3-пропионовую кислоту — антиоксидант и потенциальное средство против болезни Альцгеймера.
Улучшить микробиом сегодня
Микробиом сложно устроен и влияет на многие аспекты здоровья человека. При этом он очень чутко реагирует на смену условий и особенно на изменения рациона. Поэтому через микробиоту можно безболезненно улучшить состояние организма, достаточно лишь узнать ее актуальные характеристики и подобрать подходящий режим питания.
С помощью индивидуально подобранной диеты вы сможете показать своей микробиоте, как много она для вас значит, и отблагодарить ее за заботу о вашем здоровье.
Автор: Юлия Кондратенко
Источник: econet