В США одобрено применение первого «коктейля из антител» против Covid-19
16 декабря 2021 г.
Препарат поможет тем, кто не получил необходимую защиту от вируса после вакцинации.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило первый препарат AstraZeneca против COVID-19, содержащий антитела. Он предназначен для предотвращения заражения людей с уязвимым и ослабленным иммунитетом.
Препарат, который официально называется Evushield, представляет собой комбинацию двух моноклональных антител — тиксагевимаба и цилгавимаба. Они вводятся путём внутримышечной инъекции и обеспечивают надёжную защиту от инфекции на срок до шести месяцев.
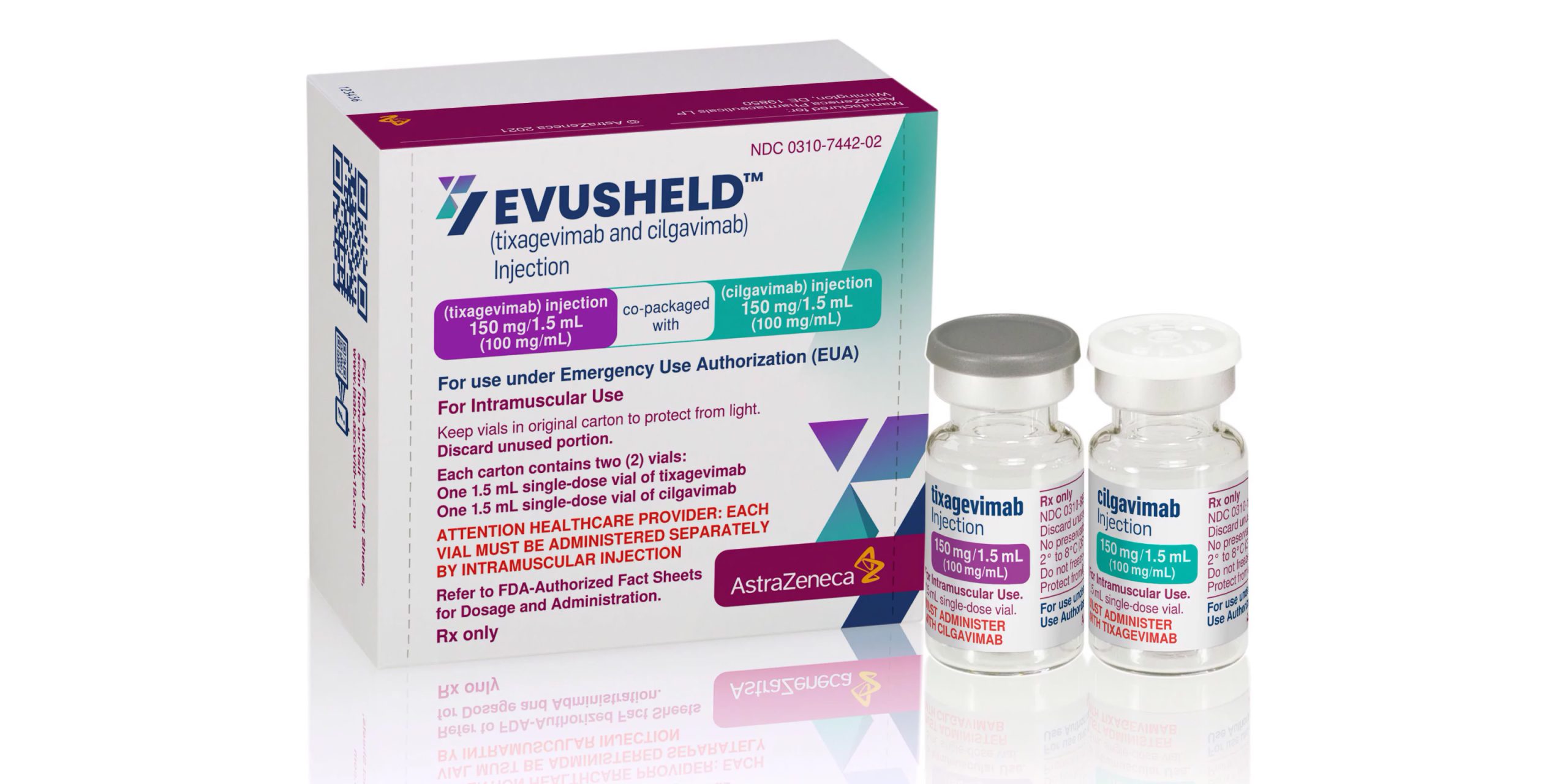
Изображение: AstraZeneca
Первоначально антитела были выделены исследователями из Медицинского центра Университета Вандербильта у выздоровевших пациентов с COVID-19 в 2020 году. AstraZeneca лицензировала результаты, а затем оптимизировала антитела, чтобы увеличить их устойчивость и продлить период распада.
Evushield был испытан в качестве профилактического средства для лиц с высоким риском тяжелого течения болезни, госпитализированных пациентов с COVID-19 и тех, кто подвергся воздействию вируса, но пока не дал положительного результата теста. Было обнаружено, что лечение является наиболее эффективным для первой группы испытуемых — именно для них FDA и одобрило использование препарата.
При последующем шестимесячном наблюдении в третьей фазе тестирования Evushield доказал свою эффективность, сократив вероятность симптоматического COVID-19 на 83%. В испытании участвовали и непривитые люди, но разрешение FDA в первую очередь нацелено на вакцинированных, у которых не наблюдается эффективного иммунного ответа.
«Миллионы людей в США и во всём мире по-прежнему подвергаются серьёзному риску заболевания COVID-19 из-за того, что их иммунная система не вырабатывает достаточного иммунного ответа даже после получения всех рекомендуемых доз вакцины. Я рад предложить своим пациентам Evusheld как новую, легко управляемую опцию, которая обеспечивает длительную защиту и может помочь им вернуться к нормальной жизни».
Майрон Левин, исследователь Медицинской школы Университета Колорадо, работавший над клиническим испытанием Evushield
В разрешении FDA на экстренное использование Evushield чётко указано, что это лечение не является альтернативой вакцинации или лечению COVID-19 у тех, у кого уже есть положительный результат теста. Лечение разрешено лишь в качестве дополнительной защиты для самых уязвимых групп населения, к примеру, тех, кто проходит химиотерапию или принимает иммунодепрессанты. В США это минимум 7 миллионов человек, а по всему миру их гораздо больше.
Источник: lifehacker.ru